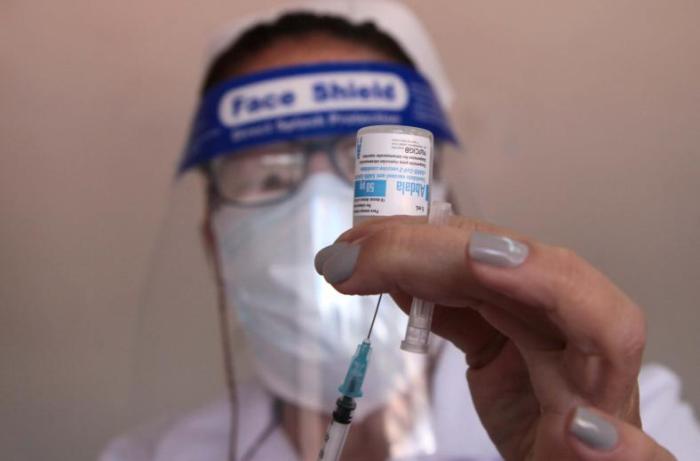
El Centro para el Control Estatal de Medicamentos, Equipos y Dispositivos Médicos (Cecmed) realiza actualmente el análisis del expediente para emitir el autorizo de uso de emergencia del candidato vacunal cubano anti-COVID-19 Abdala, desarrollado por el Centro de Ingeniería Genética y Biotecnología (CIGB).
También inspecciona el proceso productivo, para lo cual se comprueba la producción del fármaco en el CIGB y los Laboratorios Aica, con vistas a avalar el cumplimiento de las Buenas Prácticas de Fabricación.
Próximamente se prevé que el Instituto Finlay de Vacunas presente la documentación requerida para optar por esa posibilidad con el candidato vacunal Soberana 02.
Nunca se termina de evaluar una vacuna, tras su certificación se mantiene la vigilancia en el mercado y se realiza el proceso de liberación de los lotes fabricados para garantizar calidad, seguridad y eficacia en el producto, afirmó a la Agencia Cubana de Noticias Olga Lidia Jacobo Casanueva, directora del Cecmed.
La obtención de una vacuna constituye un proceso complejo que puede durar varios años e involucra tanto a sus fabricantes y las autoridades sanitarias, como el acompañamiento de las entidades reguladoras, las cuales controlan cada paso antes de la inclusión del primer voluntario y luego de alcanzado el registro sanitario.
Explicó la directiva que para lograr la autorización de uso de emergencia es preciso cumplir con los requerimientos establecidos en el país, los cuales están acordes a los estándares internacionales, en cuanto a estudios preclínicos, ensayos clínicos y los aspectos que avalan la calidad del producto.
Dicho estatus regulatorio posibilita el uso masivo del inmunógeno -oficialmente como vacuna- en el territorio nacional, y su comercialización a otras naciones mientras se mantenga la emergencia sanitaria, por lo que el camino continúa hacia la obtención del Registro Sanitario definitivo.
Todas las vacunas empleadas en el mundo contra la COVID-19 solo poseen el autorizo de uso de emergencia, al ser el registro sanitario una etapa posterior de regulación que requiere mayor número de evidencias científicas.
Jacobo Casanueva dijo que los promotores de las investigaciones pueden solicitar al Cecmed el registro sanitario una vez concluida la fase III de ensayos clínicos –que no termina con el resultado de eficacia–, y cuando se obtengan todas los datos sobre la seguridad, eventos adversos del producto, respuesta inmune en el tiempo, a partir de su empleo masivo por un periodo más largo.
El proceso de registro de vacunas implica mayor rigor que el de otros medicamentos, al utilizarse en personas sanas y con más frecuencia en niños, por lo que el Cecmed verifica no solo la documentación, sino el cumplimiento de Buenas Prácticas Clínicas en los vacunatorios y sitios clínicos, la adherencia al protocolo y el consentimiento informado de los voluntarios, insistió la especialista.
Con el autorizo de uso de emergencia los fabricantes de las vacunas contra el coronavirus SARS-CoV-2 pueden solicitar a la Organización Mundial de la Salud (OMS) el proceso de revisión, que se realiza a través de la evaluación de expertos internacionales.
La directora del Cecmed expresó que este paso no determina el uso de los inmunógenos en el país o su comercialización en el extranjero, pero sí les facilita el acceso a otras naciones y les confiere legitimidad con la inclusión en un listado de vacunas recomendadas por ese organismo.
Asimismo, puntualizó que Cuba cuenta con dos vacunas precalificadas por la OMS: Heberbiovac HB, contra la hepatitis B recombinante, y Quimi-Hib vacuna conjugada contra la bacteria Haemophilus influenzae tipo b.
El Cecmed, como autoridad reguladora cubana, continúa acompañando el desarrollo de los cinco candidatos vacunales cubanos anti-COVID-19 (Soberana 01, Soberana 02, Soberana Plus, Abdala y Mambisa) y una vez sean considerados oficialmente vacunas también mantendrá la vigilancia en su aplicación masiva.
Durante los 15 meses de enfrentamiento a la pandemia, un pequeño equipo multidisciplinario de la institución ha tenido el enorme reto de verificar y aprobar cada detalle de las investigaciones en un corto periodo de tiempo, sin que por ello se descuidara el rigor científico, la ética y la exigencia.
Autorizos a ventiladores pulmonares, diagnosticadores, medios de cultivo y de transporte, medicamentos como Jusvinza e Itolizumab, son algunos ejemplos de la impronta del centro en la batalla contra el coronavirus.
 Escambray Periódico de Sancti Spíritus
Escambray Periódico de Sancti Spíritus











Escambray se reserva el derecho de la publicación de los comentarios. No se harán visibles aquellos que sean denigrantes, ofensivos, difamatorios, o atenten contra la dignidad de una persona o grupo social, así como los que no guarden relación con el tema en cuestión.